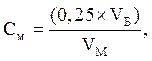Раствор соли Мора (0,25 н.), титрованный
Раствор соли марганца
Раствор серной кислоты (1:15) для перманганатной окисляемости
1 объем концентрированной серной кислоты квалификации не хуже «ч.д.а» медленно, при постоянном перемешивании, отводя выделяющееся тепло (Техника безопасности!)добавляют к 14 объемам дистиллированной воды в подходящей посуде. К теплому (температура 40 °С) раствору по каплям добавляют 0,01 н. раствор перманганата до стабильного бледно-розового оттенка.
Раствор серной кислоты (10%)
В мерную колбу вместимостью 100 мл помещают 20-30 мл дистиллированной воды. Туда же постепенно, при перемешивании, добавляют пипеткой 5,4 мл концентрированной серной кислоты. (Техника безопасности!).Раствор перемешивают покачиванием и добавляют дистиллированную воду до метки 100 мл.
Раствор приготавливают в подходящей посуде из 4-водного сульфата марганца (концентрация 480 г/л) либо 4-водного хлорида марганца (концентрация 425 г/л) в дистиллированной воде.
В мерную колбу вместимостью 1 л помещают 49,0 г соли Мора (NH4)2Fe(SO4)2×6H2O и 100-150 мл дистиллированной воды. Туда же осторожно добавляют при перемешивании 10 мл концентрированной серной кислоты (Техника безопасности!), после чего доводят объем раствора дистиллированной водой до 1 л. Хранят раствор в плотно закрытой посуде не более 6 мес.
Титр (точную концентрацию) этого раствора устанавливают по раствору бихромата калия (0,25 н.) перед серией определений. Для этого в коническую колбу на 500 мл помещают 25 мл раствора бихромата, добавляют 225 мл дистиллированной воды и 20 мл концентрированной серной кислоты (Техника безопасности!). Раствору дают остыть, после чего пипеткой-капельницей к нему прибавляют 3-4 капли раствора индикатора ферроина и титруют раствором соли Мора.
Титр раствора соли Мора в г-экв/л рассчитывают по формуле:
где: 0,25 – концентрация раствора бихромата калия, г-экв/л;
VБ и VM – объемы растворов: взятого для титрования раствора бихромата и израсходованного на титрование раствора соли Мора, мл.
Раствор соляной кислоты (0,05 г-экв/л)
Раствор приготавливают из фиксанала, используя дистиллированную воду.
Раствор соляной кислоты (1:10)
К 10 мл дистиллированной воды постепенно при перемешивании добавляют 1 мл концентрированной соляной кислоты. (Техника безопасности!).
Раствор солянокислого гидроксиламина (10%)
10,0 г солянокислого гидроксиламина (NH2OH•HCl) растворяют в
90 мл дистиллированной воды.
Раствор тиосульфата натрия (ОД г-экв/л и 0,02 г-экв/л)
Приготавливаются из ампулы фиксанала (стандарт-титра) тиосульфата натрия («0,1 г-экв/л»).
Для приготовления раствора тиосульфата с концентрацией 0,1 г-экв/л содержимое ампулы количественно переносят в мерную колбу на 1000 мл. Туда же добавляют 200-300 мл свежепрокипяченной и охлажденной дистиллированной воды. Тиосульфат растворяют в указанном количестве воды, после чего объем раствора в мерной колбе доводят до метки такой же дистиллированной водой. Приготовленного раствора тиосульфата достаточно для выполнения 1000 и более анализов.
Для приготовления 0,02 г-экв/л раствора тиосульфата 20,0 мл раствора с концентрацией 0,1 г-экв/л, отмеренные с помощью цилиндра, помещают в мерную колбу на 100 мл, после чего объем раствора в мерной колбе доводят до метки дистиллированной водой.
Для повышения стабильности растворов тиосульфата к ним следует добавить 10 мл амилового или изобутилового спирта (либо 1-2 мл ксилола или хлороформа) на 1 л раствора.
Растворы используют не ранее чем через 10 дней после приготовления.
В процессе использования раствора следует периодически (например, перед началом полевых работ) устанавливать точную концентрацию стандартного раствора тиосульфата методом титрования раствором бихромата калия.
Раствор трилона Б (0,05 г-экв/л)
Раствор приготавливают из фиксанала, используя дистиллированную воду.
Раствор хромата калия (10%)
10,0 г К2СrO4 растворяют в 90 мл дистиллированной воды.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Методика определения концентрации (стандартизация) раствора соли Мора.
Точную концентрацию соли Мора устанавливают по стандартному раствору KMnO4 (по глухому опыту).
Бюретку ополоснуть раствором KMnO4, затем заполнить ее раствором KMnO4 до 0 (носик бюретки должен быть заполнен раствором KMnO4). Другую бюретку ополоснуть раствором соли Мора, затем заполнить ее раствор соли Мора до 0 (носик бюретки должен быть заполнен раствором соли Мора). Коническую колбу ополоснуть дистиллированной водой. С помощью бюретки отобрать аликвоту стандартного раствора (10,00мл) соли Мора, перенести в коническую колбу, прилить 3-5мл H3PO4 и оттитровать раствором KMnO4 до появления слабо розовой окраски в точки эквивалентности. Титрование повторяить не менее 3-х раз. Вычислить средний объём KMnO4, пошедший на титрование соли Мора. По результатам титрования рассчитать точную концентрацию стандартного раствора соли Мора.
6.1. Пример вычисления точной концентрации стандартного раствора соли Мора Сн(NH4)2Fe(SO4)2·6H2O по «Глухому опыту»
На титрование 10,00мл раствора соли Мора пошло 9,70мл раствора KMnO4 (средний объём). Вычислить Сн (NH4)2Fe(SO4)2·6H2O, если Сн(KMnO4) = 0,05103моль/л.
| Дано: Сн (KMnO4) = 0,05103 моль/л V(KMnO4) = 9,70 мл V (NH4)2Fe(SO4)2·6H2O = 10,00 мл Мэ (NH4)2Fe(SO4)2· 6H2O = =М=392,13 г/моль |   |
| mн-? |
7. Методика определения массовой доли K2Cr2O7 в техническом образце дихромата калия.
Коническую колбу ополоснуть дистиллированной водой. Пипетку ополоснуть раствором дихромата калия. Пипеткой отобрать аликвоту раствора (10,00мл) дихромата калия, перенести в коническую колбу, прилить из бюретки 20,00мл стандартного раствора соли Мора, 3-5мл раствора H3PO4. Реакционную смесь в конической колбе перемешать и через 2-3 минуты остаток стандартного раствора соли Мора (не вступившего в реакцию) оттитровать стандартным раствором метода перманганатометрии — раствором KMnO4 до появления бледно розовой окраски на серо-зелёном фоне в точке эквивалентности. Провести титрование не менее 3-х аликвот анализируемого раствора K2Cr2O7. Вычислить средний объём KMnO4, пошедший на титрование остатка соли Мора.
8. Вычисление массовой доли дихромата калия K2Cr2O7 в техническом образце
Навеску технического дихромата калия массой 0,3010г количественно перенесли и растворили в мерной колбе ёмкостью 100мл. 10,00 мл полученного раствора обрабатывают 20,00мл стандартного раствора соли Мора. На титрование остатка соли Мора, не вступившего в реакцию, ушло 8,60мл раствора KMnO4 (средний объём) с Сн (KMnO4) = 0,05103моль/л. Вычислите массовую долю K2Cr2O7 в техническом образце, если Сн(NH4)2Fe(SO4)2·6H2O, вычисленная на основании «глухого опыта» составила 0,04950 моль/л
Источник
Приложения
А.Н. Петин, М.Г. Лебедева, О.В. Крымская
Анализ и оценка качества поверхностных вод
Учебное пособие. – Белгород: Изд-во БелГУ, 2006. – 252 с.
Приложения
Приложение 1. Приготовление контрольных шкал образцов окраски для визуального колориметрирования
Контрольные шкалы образцов окраски для визуального колориметрирования приготавливают с использованием эталонных растворов, иногда называемых «стандартными сериями».
Эталонные окрашенные растворы приготавливают заблаговременно в лабораторных условиях накануне, либо за несколько дней до предполагаемых работ в полевых или лабораторных условиях. Контрольные шкалы могут быть двух видов:
1) в виде колориметрических пробирок или склянок (в зависимости от того, как предусмотрено выполнение определения) с эталонными растворами, воспроизводящими окраску проб с заданными концентрациями анализируемых компонентов;
2) в виде воспроизведенной художественным способом шкалы окрасок, максимально соответствующих окраскам эталонных растворов.
В отдельных случаях удобно заблаговременно приготовить растворы солей-стандартов, а растворы реактивов (индикаторов) добавлять в полевых или лабораторных условиях перед выполнением анализов проб.
Приготовление контрольных шкал требует достаточной подготовленности и навыков химико-аналитической работы в лабораторных условиях, соблюдения правил техники безопасности при работе с кислотами и химическими реактивами.
Эталонные растворы приготавливают согласно данным приведенных ниже алгоритмических таблиц при общем порядке операций, описанном при выполнении соответствующих определений. Для снижения трудоемкости работ эталонные растворы могут приготавливаться не для всех концентраций, а для того их интервала, где наиболее вероятен результат определения значения анализируемого показателя.
Растворы для приготовления стандартных серий должны быть использованы в день их приготовления, если иное не оговорено в описании соответствующей методики.
При использовании эталонных растворов следует учитывать сроки их годности (устойчивости).
Приведенные ниже методики приготовления эталонных растворов, содержащих в единице объема определенное количество заданного компонента, изложены в соответствии с ГОСТ 4212-76 [36].
Оборудование, реактивы и растворы, необходимые для приготовления эталонных растворов
1) оборудование, приведенное при описании анализа;
2) колбы мерные 2-го класса точности вместимостью 10 мл, 100 мл и 1000 мл;
3) весы аналитические ВЛР-200 или другого типа ;
4) рН-метр любой марки;
5.) шкаф сушильный любого типа, обеспечивающий регулировку и поддержание температуры в диапазоне 100-150 °С.
Реактивы и растворы.
1) реактивы, растворы и индикаторы, используемые при выполнении анализов;
2) реактивы-стандарты, приведенные в табл. 1, а также дополнительные реактивы и растворы.
Реактивы-стандарты для приготовления контрольных шкал
Наименование
и формула реактива
Предварительная
подготовка реактива
перед использованием
1. Аммоний, нитрат
Высушивают до постоянной массы при 105° С
2. Аммоний, хлорид
Высушивают до постоянной массы при 105° С
3. Водородный показатель (рН), фосфаты
Высушивают до постоянной массы при 120° С
Кальция хлорид плавленый CaCl2
6. Медь (металлы), сульфат
Высушивают до постоянной массы при 150°С
8. Свинец (металлы)
Натрия фторид NaF
10. Активный хлор
11. Цинк (металлы), нитрат
Допускается приготовление растворов из других солей одноименного катиона (аниона), исходя из требуемой массовой концентрации и с учетом содержания в препарате основного компонента.
Дополнительные реактивы и растворы:
1. Вода дистиллированная.
2. Вода дистиллированная, очищенная от металлов.
3. Раствор серной кислоты, 0,001 г-экв/л.
4. Раствор серной кислоты, 16 %.
5. Кислота азотная концентрированная.
Приготовление серий эталонных растворов
Приготовление растворов общего железа в форме катионов железа (II)
Приготовление основного раствора соли Мора. Навеску (0,7020±0,0010) г соли Мора, взвешенную на аналитических весах, растворяют в 20-30 мл слабого раствора серной кислоты в дистиллированной воде (содержащей 0,4 мл раствора серной кислоты с массовой долей 16 % (приготавливают, смешивая 9,7 мл концентрированной серной кислоты и 93 мл дистиллированной воды (соблюдать меры безопасности!)) и доводят объем смеси дистиллированной водой до 100 мл. Полученный раствор соли Мора содержит 1,00 мг катиона железа (II) в 1 мл (1000 мкг/мл).
Приготовление стандартных растворов соли Мора.
Раствор с концентрацией 10 мкг/мл: 1,0 мл основного раствора с помощью пипетки помещают в мерную колбу и доводят объем раствора до
100 мл раствором серной кислоты с концентрацией 0,001 г-экв/л.
Раствор с концентрацией 1,0 мкг/мл: 10,0 мл стандартного раствора с концентрацией 10 мкг/мл с помощью пипетки помещают в мерную колбу и доводят объем раствора до 100 мл раствором серной кислоты с концентрацией 0,001 г-экв/л (приготавливают из фиксанала либо смешивают 5,3 мл концентрированной серной кислоты (200-300 мл дистиллированной воды и доводят объем раствора до 1000 мл (таким образом получают раствор с концентрацией 0,1 экв/л). При последующем разбавлении полученного раствора в 100 раз получают раствор с концентрацией 0,001 г-экв/л.
Шкалу эталонных растворов приготавливают по алгоритму, приведенному в табл. 2.
Эталонные растворы общего железа стабильны в течение 3 месяцев при условии их хранения в герметично закрытых пробирках в затемненном прохладном месте.
Алгоритм приготовления шкалы эталонных растворов общего железа
Наименование раствора
и порядок его
использования
Количество раствора, мл
Номер эталонного раствора (пробы)
Стандартный раствор соли Мора с концентрацией:
1,0 мкг/мл
10 мкг/мл
Окончание табл. 2
Раствор солянокислого гидроксиламина
По 0,2 мл в каждую пробу
Ацетатный буферный раствор
По 1,0 мл в каждую пробу
По 0,5 мл в каждую пробу
Содержание железа (II) в пробе объемом 10 мл, мкг
Концентрация железа (II), мг/л
Приготовление растворов нитрит-аниона.
Приготовление основного раствора нитрит-аниона. Взвешенную на аналитических весах навеску (1,500±0,0010) г нитрита натрия, предварительно высушенного до постоянной массы при 150 °С, помещают в мерную колбу растворяют в 200-300 мл дистиллированной воды и доводят объем раствора дистиллированной водой до 1000 мл. Полученный раствор содержит 1,00 мг/мл нитрит-аниона (1000 мкг/мл).
Приготовление стандартных растворов нитрит-аниона.
Раствор с концентрацией 1,0 мкг/мл: 1,0 мл основного раствора помещают с помощью пипетки в мерную колбу и доводят объем раствора до 1000 мл дистиллированной водой.
Раствор с концентрацией 0,10 мкг/мл: 1,0 мл раствора с концентрацией 1,0 мкг/мл помещают в мерную колбу и доводят объем раствора до 10 мл дистиллированной водой.
Шкалу эталонных растворов приготавливают по алгоритму, приведенному в табл. 3. Эталонные растворы нитрит-аниона стабильны в течение рабочего дня (6-8 часов).
Алгоритм приготовления шкалы эталонных растворов
нитрит-аниона
Наименование раствора и порядок
его использования
Количество раствора, мл
Номер эталонного раствора
Стандарт. р-р нитрита натрия с концентрацией: 1,0 мкг/мл
По одной упаковке (0,05) в каждую пробу
Окончание табл. 3
Содержание нитрит-аниона в пробе объемом 5 мл, мкг
Концентрация нитрит-аниона в пробе, мг/л
Приготовление растворов нитрат-аниона
Приготовление основного раствора нитрат-аниона. Взвешенную на аналитических весах навеску (1,2910-0,0010) г нитрата аммония либо (1,6300-0,0010) г нитрата калия, предварительно высушенных до постоянной массы при 100-105°С, помещают в мерную колбу, растворяют в 200-300 мл дистиллированной воды и доводят объем раствора дистиллированной водой до 1000 мл. Полученный раствор содержит 1,00 мг/мл нитрат-аниона.
Приготовление раствора нитрат-аниона с концентрацией 0,10 мг/мл: 1,0 мл основного раствора помещают с помощью пипетки в мерную колбу и доводят до 10 мл дистиллированной водой.
Шкалу эталонных растворов приготавливают по алгоритму, приведенному в табл. 4.
Алгоритм приготовления шкалы эталонных растворов
нитрат-аниона
Наименование раствора
и порядок его
использования
Количество раствора, мл
Номер эталонного раствора (пробы)
Стандартный раствор хлорида аммония, с концентрацией:
1,0 мкг/мл
Раствор салициловой кислоты
По 5 капель в каждую пробу
Серная кислота концентриров.
По 0,5 мл в каждую пробу
20%-ный раствор гидроксида натрия
По 5,0 мл в каждую пробу
Доведение до метки «10 мл»
Содержание железа (II) в пробе объемом 10 мл, мкг
Концентрация железа (II), мг/л
Эталонные растворы нитрат-аниона стабильны в течение 3 месяцев при условии их хранения в герметично закрытых пробирках в затемненном прохладном месте.
Приготовление растворов катиона аммония.
Приготовление основного раствора. Взвешенную на аналитических весах навеску (2,9650±0,0010) г хлорида аммония, предварительно высушенного до постоянной массы при 100-105°С, помещают в мерную колбу, растворяют в 200-300 мл дистиллированной воды и доводят объем раствора дистиллированной водой до 1000 мл. Полученный раствор содержит 1,00 мг/мл катиона аммония.
Приготовление стандартных растворов. Раствор с концентрацией
10 мкг/мл: 1,0 мл основного раствора помещают с помощью пипетки в мерную колбу и доводят до 100 мл дистиллированной водой.
Раствор с концентрацией 1 мкг/мл: 1,0 мл раствора с концентрацией
10 мкг/мл помещают с помощью пипетки в мерную колбу и доводят до 10 мл дистиллированной водой.
Шкалу эталонных растворов приготавливают по алгоритму, приведенному в табл. 5.
Эталонные растворы катиона аммония стабильны в течение рабочего дня (6-8 часов).
Алгоритм приготовления шкалы эталонных растворов катиона аммония
Наименование раствора и порядок его использования
Количество раствора, мл
Номер эталонного раствора
аммония с концентрацией: 1,0 мкг/мл
Содержание аммония в пробе объемом 5 мл, мкг
Концентрация аммония, мг/л
Приготовление растворов суммы тяжелых металлов.
Приготовление основного раствора суммы тяжелых металлов. Основной раствор суммы тяжелых металлов готовят из смеси солей или металлов цинка, меди и свинца в молярных соотношениях 3:1:1. С этой целью в мерную колбу вместимостью 1000 мл помещают взвешенные на аналитических весах навески (1,7741±0,0010) г нитрата цинка 6-водного, (0,4994±0,0010) г сульфата меди (II) 5-водного и (0,7579±0,0010) г ацетата свинца 3-водного (либо эквивалентные им количества металлических цинка, меди и свинца – 0,390 г, 0,127 г и 0,414 г соответственно). В колбу мерным цилиндром приливают 20 мл концентрированной азотной кислоты (осторожность при выполнении операции!) и после растворения солей (металлов) добавляют дистиллированную воду до метки. Полученный раствор имеет концентрацию 0,01 г-моль/л по умме металлов.
Основной раствор устойчив в течение 3 месяцев.
Приготовление стандартного раствора. Вспомогательный раствор:
1,0 мл основного раствора помещают с помощью пипетки в мерную колбу вместимостью 100 мл и добавляют до метки дистиллированную воду, очищенную от металлов обработкой раствором дитизона. Полученный раствор имеет концентрацию 0,0001 г-моль/л и должен быть использован в течение рабочего дня.
Стандартный раствор: 1,0 мл вспомогательного раствора (0,0001 г-моль/л) помещают с помощью пипетки в мерную колбу вместимостью 100 мл и добавляют до метки дистиллированную воду, очищенную от металлов. Стандартный раствор имеет концентрацию 0,000001 г-моль/л (1×10 6 мг-моль/мл) и должен быть использован в течение рабочего дня.
Шкалу эталонных растворов приготавливают по алгоритму, приведенному в табл. 6. Экстракцию раствором дитизона проводят в делительной воронке, после расслоения жидкостей органический слой сливают в колориметрическую пробирку.
Эталонные растворы суммы тяжелых металлов стабильны в течение рабочего дня (6-8 часов).
Алгоритм приготовления шкалы эталонных растворов суммы металлов
Наименование раствора и порядок его использования
Источник