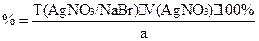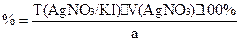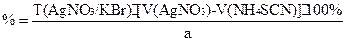Метод Мора — NaCl, KCl, NaBr, KBr — ГФ X
Количественное определение галогенидов
Точную навеску препарата растворяют в воде и титруют 0,1М AgNO3 с индикатором K2CrO4 при pH=6-8 до оранжево-желтого окрашивания.
Ограничения: в кислой среде CrO4 2- à Cr2O7 2- и обр. осадок Ag2Cr2O7¯ другого цвета. Метод пригоден только для бесцветных растворов. Метод не используется для I — , т.к. AgI¯ образует коллоидный раствор, затрудняющий осаждение в точке эквивалентноси, мешают SO4 2- , S 2- , PO4 3- , AsO4 3- , BO3 3- , взаимодействующие с Ag + с образованием осадков. Мешают также Hg 2+ , Pb 2+ , Ba 2+ , из-за образования осадков с индикатором.
Среда для титрования нейтральная или слабощелочная, т.к. в сильнощелочной среде выпадает черный осадок:
Ag + + OH — à AgOH à Ag2O¯
f(NaBr)=1;
Метод Фаянса – KI, NaI (ГФ X)
Точную навеску препарата предварительно высушивают при 110 С, растворяют в 30 мл воды, прибавляют 1,5 мл. CH3COOH, 5 капель раствора эозината натрия и титруют 0,1M AgNO3 до перехода окраски от желтой до розовой. рН – слабокислая (CH3COOH). Индикатор – адсорбционный (эозинат натрия – рис, [Ind 2- ](Na + )2 )
KI + AgNO3 
Избыток Ag: AgI¯ 
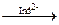
Частица индикатора связывает 2 коллоидные частицы [AgI•Ag] + , происходит коагуляция.
f(KI)=1;
Индикатор – соль органической кислоты, диссоциирует в растворе. В присутствии минеральных кислот диссоциации и окрашивания нет.
Можно также определять Cl, Br (НЕ ГФ)
Навеску растворяют + бромфеноловый синий + CH3COOH до зеленоватого цвета, титруют до фиолетового окрашивания.
Метод Фольгарда – Br, I, (Сl)
Обратное титрование. Титрант – 0,1M AgNO3, Ind – FeNH4(SO4)2 (железоаммонийные квасцы); pH=3 (HNO3). Избыток AgNO3 оттитровывают NH4SCN.
KBr + AgNO3 точн. избыток 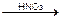
избыток AgNO3 + NH4SCN 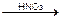
КТТ: 3NH4SCN + FeNH4(SO4)2 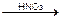
Преимущества: можно титровать в кислой среде, не мешают ионы.
Недостатки: меньше точности, для Cl — очень осторожно, т.к. ПР(AgCl) > ПР(AgSCN), AgCl будет растворяться и превращаться в AgSCN. Добавляют органический растворитель, экранирующий AgCl.
При определении I — , Fe 3+ индикатора – окислитель. I — à I2, поэтому индикатор добавляют в последний момент.
f(KBr)=1;
Метод Кальтгоффа-Стенгера – Br —
Титранты – 0,1M AgNO3; 0,1M NH4SCN, обратное титрование. Титруют до розового окрашивания. Отличае от метода Фольгарда в порядке добавления титрантов. Индикатор – железоаммонийные квасцы FeNH4(SO4)2
3NH4SCN точн. избыток + FeNH4(SO4)2 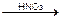
Титруют: KBr + AgNO3 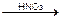
AgNO3 + NH4SCN 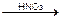
f(KBr)=1;
Преимущества: мало расходуется нитрат серебра. Используют для определения бромкамфоры после минерализации.
Метод Кальтгоффа – I — в присутствии Cl, Br – йодкрахмальный метод
Раствор препарата + 1 капля KIO3 + раствор крахмала и H2SO4 разв. до появления синего окрашивания.
KIO3 + 5KI + 3H2SO4 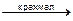
Титруют AgNO3 до исчезновения синего окрашивания.
f(KI)=1;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Метод Мора



Метод Мора является одним из аргентометрических методов. Все эти методы основаны на реакции:
Аg + + Наl — → АgНаl↓
Метод Мора является наиболее простым из всех методов аргентометрии и в то же время достаточно точным. Титрантом является раствор нитрата серебра АgNОз 0.1 моль/л.
В основу метода Мора положена реакция взаимодействия ионов серебра с С1 — или Вг — .
Индикатором является хромат калия К2СгО4 5 %. Установочным веществом для определения титра раствора является NаС1 или КС1 0.1 моль/л.
Метод Мора позволяет определить количество хлоридов или бромидов. Иодиды этим методом не определяют, так как выпадающий в осадок иодид серебра АgI сильно адсорбирует К2СгО4, поэтому точку эквивалентности определить невозможно.
Растворимость АgСl значительно меньше, чем растворимость Аg2СгO4. Поэтому если постепенно добавлять раствор АgNOз к раствору, содержащему Сl — и CrO4 2- , то ПРAgС| достигается раньше ПР Аg2СгO4.
Это означает, что вначале образуется труднорастворимая соль
После того как хлорид-ионы будут практически полностью выделены в виде АgС1, появляется осадок. Происходит изменение окраски титруемой смеси и таким образом определяется конец титрования.
При титровании раствора бромида происходит аналогичное явление. Так как ПРАgВг + + 2OH — → Ag2O↓ + H2O
2. Определение нельзя проводить в присутствии ионов Ва 2+ , Вi 3+ , Рb 2+ , так как эти ионы образуют с ионами СгО4 2 — осадки.
3. Титрование всегда ведут от галогенида к АgNOз (т. е. галогенид титруют раствором АgNОз, а не наоборот). Только при таком условии кирпично-красный осадок Аg2СгО4 образуется в точке эквивалентности.
Метод Мора находит широкое применение при анализе пищевых продуктов. Количество поваренной соли в колбасе, соленой рыбе, масле и других продуктах определяют по методу Мора.
Этот метод применяется также для определения хлоридов в воде. Метод Мора используется и при анализе некоторых фармацевтических препаратов, например хлоридов и бромидов натрия и калия.
Определение хлоридов методом Мора
Приготовление титранта 0.05 моль/л раствора. Нитрат серебра не относится к тем веществам, из которых можно приготовить раствор заданной концентрации по точно взятой навеске. Поэтому готовят раствор примерно требуемой концентрации, а его титр устанавливают. Необходимую навеску (8.5 г AgNОз на 1 л раствора) отвешивают с точностью до 0.1 г на технических весах, и нужное количество воды отмеривают мерным цилиндром. Раствор сохраняют в темноте, так как на свету нитрат серебра разлагается. Однако и при надлежащем хранении титр раствора АgNОз меняется с течением времени и его необходимо время от времени проверять.
Приготовление установочного раствора. Для приготовления 0.05 моль/л, раствора NаС1 отвешивают на аналитических весах 0.2922 г NаС1 и количественно переносят в мерную колбу вместимостью 100 мл. Растворяют навеску в дистиллированной воде, доводят раствор до метки и хорошо перемешивают. Таким образом получают раствор NаС1.
Определение титра нитрата серебра. В качестве индикатора применяют 5 % раствор хромата калия К2СгО4 в воде. Наполняют бюретку раствором нитрата серебра АgNОз. Отобрав пипеткой 10 мл 0.05 моль/л раствора NаС1, переносят ее в колбу Эрленмейера вместимостью 250 мл, добавляют 0.5 мл раствора индикатора, немного разбавляют водой и медленно титруют 0.1 моль/л раствором АgNОз, непрерывно перемешивая жидкость до появления первого неисчезающего изменения цвета суспензии. Нужно уловить момент, когда лимонно-желтый цвет суспензии приобретет от капли АgNОз слегка красноватый оттенок. Запись анализа и расчеты производят так же, как при определениях кислотно-основным методом.

Определение хлорида в растворе. Раствор хлорида помещают в мерную колбу на 100 мл, доводят дистиллированной водой до метки и перемешивают. Для титрования отбирают в коническую колбу 10 мл полученного раствора, немного разбавляют водой, добавляют 0.5 мл раствора К2СгO4 и титруют раствором АgNОз до изменения окраски содержимого колбы из лимонно-желтой в желто-розовую. Рассчитывают содержание хлора в полученном растворе (в граммах).
Источник
Определение содержания соли методом Мора



Определение соли методом Мора основано на реакции обмена между хлористым натрием и азотнокислым серебром в присутствии индикатора хромата калия, в результате чего в нейтральном растворе после осаждения всех ионов хлора образуется кирпично-красный осадок
Техника определения:
В химический стакан на 100 мл взвесьте 20 г. измельченной пробы, прибавьте небольшое количество дистиллированной воды и тщательно размешайте стеклянной палочкой. Полученную смесь количественно перенесите в мерную колбу на 250 мл, долейте до 3/4 ее объема дистиллированной водой, закройте пробкой. Содержимое колбы тщательно перемешайте и поставьте на 30 минут для настаивания. После этого долейте колбу до метки дистиллированной водой, закройте пробкой, тщательно перемешайте и профильтруйте через сухой складчатый фильтр в чистую колбу на 200 мл.
Из фильтра пипеткой возьмите 10 мл и перенесите в коническую колбу на 50 мл; добавьте 3-4 капли насыщенного раствора хромовокислого калия и оттитруйте 0,05 н или 0,1 н раствором азотнокислого серебра до появления красно-бурой окраски, не исчезающей в течение 0,5 минуты. Процентное содержание поваренной соли рассчитайте по формуле:
X= V x n x K x V2 x 100
где V — объем раствора азотнокислого серебра, израсходованного на титрование, мл;
n — количество хлористого натрия, соответствующее I мл раствора азотнокислого серебра (для 0,05 н = 0,0029; для 0,1 н = 0,00585), г;
К — поправочный коэффициент точно на 0,05 н или 0,1 н раствора АgNО3;
V1— объем вытяжки, взятой для титрования, мл;
V2 — количество дистиллированной воды, взятой для настаивания, мл.
Определение кислотности
Кислотность является одним из показателей качества блюд, содержащих молочные продукты. Кислотность выражается в градусах Тернера (°Т). Под градусом Тернера подразумевают объем водного раствора NaОН с концентрацией 0,1 моль/дм 3 , необходимый для нейтрализации кислот и их кислых солей в 100 см 3 или 100 г. продукта.
Техника определения:
Поместите две навески по 5 г в химический стакан емкостью 150. 200 см, добавьте 50 см 3 воды (35. 40 °С) и разотрите палочкой с резиновым наконечником, добавьте к содержимому 3 капли фенолфталеина и оттитруйте 0,1 моль/дм 3 NaОН до слабо-розового окрашивания, не исчезающего (при спокойном состоянии пробы) 1 мин.
Кислотность творожных полуфабрикатов рассчитайте по формуле:
Х=20 х а х К,
где X — кислотность, °Т;
20 — коэффициент пересчета результатов титрования в градусы Тернера;
К— поправочный коэффициент к 0,1 моль/ дм;
а — объем щелочи, пошедший на титрование, см
Расхождение между параллельными определениями не должно превышать 4 Т.
Экспериментальный раздел
Определение органолептических показателей
3.1.1 Приготовление блюда «Суп луковый по-крестьянски»
В условиях технологической лаборатории было приготовлено блюдо «Суп луковый по-крестьянски» в количестве одной порции выходом 350 г. Данная масса не соответствует выходу, установленному в технико-технологической карте. Разница составляет 50 грамм (12,5%).
Органолептическая оценка блюда
Органолептическую оценку проводим при Т= 75*С по пяти показателям. Результаты органолептической оценки приведены в таблице (табл. 3.1.2.1)
Таблица 3.1.2.1 Органолептическая оценка
| Показатель | Количество баллов | Снижение | Количество баллов после снижения | Оценка |
| Внешний вид | 5 | 0 | 5 | |
| Цвет | 5 | 0 | 5 | |
| Консистенция | 5 | 2 | 3 | |
| Запах | 5 | 0 | 5 | |
| Вкус | 5 | 0 | 5 | |
| Сумма баллов | 5 | 23 | отлично |
Внешний видблюда не имеет дефектов и соответствует продукции высокого качества. Данный показатель получил 5 баллов
Цветблюда светло-кремовый.
Такой показатель как консистенцияполучил 3 балла из пяти возможных, 2 балла снимаются за то, что консистенция густая.
Вкусвыразительный, сливочно-луковый, не имеет дефектов и соответствует продукции высокого качества. Вкус за не имением дефектов получает 5 баллов.

Запах выразительный, соответствующий данному блюду, не имеет дефектов и получает 5 баллов.
Вывод:блюдо получило оценку «отлично» (23 балла). Два балла было снято за слишком густую консистенцию. Причиной данного дефекта является нарушение технологического процесса, например несоблюдение температурного режима.
Рекомендации:следует строго соблюдать температурный режим и технологию приготовления блюда.
Доставка блюда «Суп луковый по-крестьянски» в биохимическую лабораторию
После приготовления блюда «Суп луковый по-крестьянски» в пищевой лаборатории его необходимо транспортировать в биохимическую лабораторию. Для транспортировки используется индивидуальная тара, которая имеет маркировку с указанием наименования блюда, фамилии студента и даты изготовления блюда.
Определение физико-химических показателей
Подготовка образцов к анализу
Средняя проба блюда “Суп луковый по-крестьянски ” взвешивается, разогревается до 40*С и измельчается в гомогенизаторе в течении 3 минут до однородной массы. Подготовленная проба переносится в чашку.
Определение физико-химических показателей качества блюда «Суп луковый по-крестьянски»
В данном разделе определяются физико-химические показатели качества, заданные преподавателем.
Сущность и методика проведения данных экспериментов приведена в теоретическом разделе.
Проведение расчетов
В данном разделе производится обработка данных, полученных при проведении экспериментов.
Источник